我科学家在世界上首次培育出带有基因剪刀的工具猪
- 来源:智网新闻
- 2017-11-23

广州生物院在世界上首次培育出带有基因剪刀的工具猪 。
据中国科学院广州生物医药与健康研究院最新消息,该院赖良学研究员课题组首次构建了新型条件性表达Cas9基因工具猪模型,利用此模型,率先实现了直接对成体大动物进行体内基因编辑,并首次建立了大动物原发性肺癌模型。最新研究成果于11月16日在线发表在《基因组研究》上。
由于猪在器官结构、大小以及生理代谢、免疫系统等方面与人接近,被普遍认为是理想的大动物疾病模型、异种器官移植供体模型和异种器官再造受体模型。但要获得这些模型,需要对猪进行基因组编辑。目前,对猪等大动物在体内直接进行基因突变,技术上尚不可行。
猪的基因组编辑主要依赖于受精卵注射或体细胞核移植技术来实现。通过前者技术建立的基因编辑动物易产生嵌合体,且需繁殖到第二代,甚至第三代,花2-3年的时间才能够获得;后者技术制备的基因编辑大动物模型,受多种不可控因素影响,体细胞克隆成功率非常低,同样耗时、耗力,且成本极高。 该课题组利用基因打靶技术,成功地将能够剪开基因的Cas9蛋白基因插入到猪基因组的一个特定位点,相当于在猪体内加入一把基因剪刀,并且在Cas9基因附近加上了能与Cre重组酶结合的loxp位点,后者相当于一个开关,能对其剪切功能的开启加以控制。他们利用此工具模型,不需要依赖受精卵注射或体细胞核移植技术,在动物体内转入能识别特定基因的gRNA和重组酶,就可直接对猪的基因组进行编辑,从而快速获得相应基因编辑猪模型。
课题组还将含有Cre重组酶和靶向六种肿瘤相关基因的gRNAs慢病毒通过滴鼻方式,感染工具猪的肺脏,在猪肺细胞的基因组发生癌化突变。三个月后,猪出现了典型的肺癌症状和病理变化,从而成功地建立了原发性肺肿瘤大动物模型。
利用条件性表达Cas9基因猪模型,可高效的实现大动物体内细胞单基因、多基因、超大片段基因的编辑。这一研究成果将推动猪基因功能的研究进展和加快在生物医药、农业领域的基因修饰猪模型建立。


 闰秒将在2035年取消
闰秒将在2035年取消 国产大型太阳能无人机“启明星50”首飞成功
国产大型太阳能无人机“启明星50”首飞成功 中国发现月球新矿物,命名为“嫦娥石”
中国发现月球新矿物,命名为“嫦娥石”
 科技界内卷化如何破
科技界内卷化如何破 再谈创新与企业家精神
再谈创新与企业家精神 字节跳动的失意版图
字节跳动的失意版图






 中国乌克兰共同举办展览 科技创新合作为中乌关系增添强劲动力
中国乌克兰共同举办展览 科技创新合作为中乌关系增添强劲动力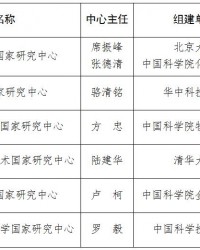 科技部批准组建北京分子科学等6个国家研究中心
科技部批准组建北京分子科学等6个国家研究中心